Aumento dell’omocisteina. Solo patologie vascolari?
Onnivoro, vegetariano o vegano? Nutriattentariano, grazie!!!
L.Allegretti
Iperomocisteinemia: non è solo una parola impronunciabile!!!
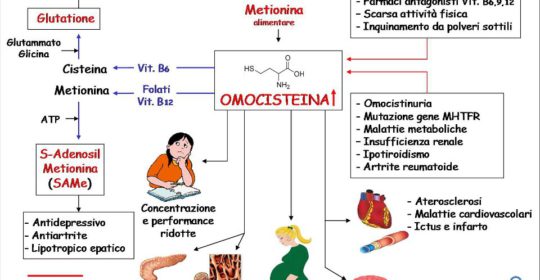
L’iperomocisteinemia consiste in una eccessiva concentrazione di omocisteina nel sangue.
L’omocisteina è un aminoacido prodotto dal metabolismo della metionina, un aminoacido essenziale che viene introdotto nel nostro organismo con la dieta (proteine).
Il suo metabolismo viene regolato grazie all’attività di enzimi e vitamine come i folati e le vitamine B6 e B12. Una carenza di queste vitamine può fare sì che l’omocisteina si accumuli danneggiando le pareti dei vasi sanguigni. Quando i livelli plasmatici dell’omocisteina arrivano a concentrazioni troppo elevate, ovvero superano il valore di 12 µmol/L, si parla di iperomocisteinemia.
Elevati livelli di questo aminoacido influenzano negativamente le funzioni del sistema nervoso, cardiovascolare ed osseo, in particolar modo attraverso un incremento della produzione di radicali liberi e lo stress ossidavo che a questo consegue. Per questa ragione l’iperomocisteinemia è considerata un fattore di rischio per lo sviluppo di malattie cardiovascolari, cerebrali (è stata associata a un maggior rischio di sviluppare demenza di Alzheimer) e per fratture ossee di natura osteoporotica.
I valori plasmatici dell’omocisteina
I valori plasmatici dell’omocisteina a digiuno sono più elevati nell’uomo che nella donna in pre-menopausa (del 10-20%), per essere poi uguali dopo la menopausa. I valori di omocisteina aumentano con l’età, del 7-12% ogni 10 anni e aumentano di 2-4 volte nell’insufficienza renale cronica (valori >28 μmol/L), più per alterato metabolismo che per ridotte escrezioni, riducendosi dopo la dialisi. I valori dell’omocisteina aumentano nei forti fumatori (+20%), in rapporto al numero di sigarette fumate e negli alcolisti. Alcuni farmaci, principalmente antiepilettici e diuretici, causano innalzamento dei valori di omocisteina totale.
Livelli Normali di Omocisteina sono considerati tra 5 e 9 μmol/L ( micromoli per litro).
L’OMS (Organizzazione Mondiale della Sanità) considera fino a 13 µmoli/l un valore ematico normale pertanto si parla di omocisteina alta quando si misurano nel sangue concentrazioni:
- superiori a 13 µmoli/l negli uomini adulti,
- superiori a 10,1 µmoli/l per le donne,
- superiori a 11,3 µmoli/l nei ragazzi di età inferiore ai 14 anni.
Le raccomandazioni della Task Force Internazionale per la Prevenzione della Malattia Cardiovascolare dicono che: secondo la prassi corrente i livelli di omocisteina > 12 µmoli/l meritano attenzione.
Si parla di iperomocisteinemia cioè elevati livelli di Omocisteina nel sangue di tipo:
- Borderline quando il valore plasmatico di omocisteina è di 10-12 µmoli/l
- Moderata* quando è di 13-30 µmoli/l
- Intermedia* quando è di 30-100 µmoli/l
- Severa se il valore plasmatico di omocisteina è superiore a 100 µmoli/l; i casi più severi sono dovuti a difetti allo stato omozigote dei geni che codificano per gli enzimi del metabolismo dell’omocisteina in particolare il CBS (omocistenuria) o di particolari carenze della Vitamina B6.
*Livelli di omocisteina moderata o intermedia osservati a digiuno possono essere riscontrati in casi di difetti genetici eterozigoti degli enzimi coinvolti nella ri-metilazione o per cause carenziali-nutrizionali comportanti un deficit vitaminico.
Le cause dell’iperomocisteinemia
La concentrazione plasmatica di omocisteina è il risultato di una stretta relazione tra le abitudini dietetiche e i fattori genetici predisponenti. Le cause genetiche stanno a quelle dietetico/comportamentali in rapporto 1:10; infatti la maggior parte delle persone ha elevati livelli di omocisteina nel sangue a causa di una dieta non sufficientemente ricca di folati e delle altre vitamine del gruppo B.
CAUSE GENETICHE
Le alterazioni genetiche causano deficit degli enzimi coinvolti nel ciclo di smaltimento dell’omocisteina.
Uno è il deficit dell’enzima cistationina-beta-sintetasi, dovuto a una mutazione genetica molto rara (Omocistinuria*); l’altro è il polimorfismo genetico T833C relativo sempre a questo enzima che provoca anch’esso un aumento dei livelli di omocisteina. Recenti studi hanno dimostrato una associazione significative tra questo polimorfismo e il rischio di ictus.
Livelli elevati di omocisteina possono essere dovuti anche alla mutazione del gene responsabile della produzione dell’enzima metilenetetraidrofolato-reduttasi (MTHFR). È inoltre stato identificato un polimorfismo genetico, abbastanza frequente nella popolazione generale, come responsabile dell’aumento dei livelli omocisteina e caratterizzato dalle mutazioni C677T e 1298A/C; di queste, la prima sembrerebbe essere la più importante sotto il profilo del rischio trombotico, comportando una riduzione dell’attività enzimatica della MTHFR pari al 50%.
I fattori che determinano elevati livelli plasmatici di omocisteina possono essere molteplici e sono:
- una dieta non equilibrata che comporta deficit vitaminico, squilibrio tra proteine animale e proteine vegetali, gli eccessi di fumo, di caffè e alcool;
- fattori fisiologici quali il sesso, l’invecchiamento, la riduzione della funzionalità renale e l’ipotiroidismo;
- fattori genetici;
- alcuni farmaci quali gli inibitori della pompa protonica, gli antiepilettici, gli anticoncezionali orali, i farmaci anti-Parkinson, il metotrexate.
Iperomocisteinemia: fattore di rischio e patologie vascolari
L’omocisteina in eccesso provoca un danno vascolare coinvolgendo sia la struttura della parte vascolare che il sistema di coagulazione del sangue.
Danno alla parete vascolare
Il deposito di omocisteina sulla parete vasale è istolesivo attraverso diverse modalità.
I vasi arteriosi sono fondamentalmente costituiti da due parti funzionali: le cellule muscolari lisce e l’endotelio. Le cellule muscolari lisce possono contrarsi a seguito di un impulso nervoso, o tramite influenze dirette di varie sostanze o indirettamente attraverso un meccanismo di reattività vasale endotelio-dipendente. In quest’ultimo caso l’endotelio rilascia alcune sostanze vasoattive. Tra i vasodilatatori, l’ossido nitrico (NO) è il più importante e viene prodotto dall’endotelio attraverso il metabolismo dell’arginina grazie ad una NO-sintetasi (NOS). Nonostante i dati siano ancora limitati, è stato dimostrato che l’omocisteina influenza la funzione vascolare mediante un’azione indiretta sul tono vascolare, che induce una maggiore costrizione mediata dal legame dell’omocisteina ridotta con l’ossido nitrico e relativa formazione di ossido nitroso. Livelli di omocisteina cronicamente elevati provocano una deplezione dell’ossido nitrico e una produzione di ossido nitroso che resta in circolo solo per 14 minuti. La conseguenza è che il soggetto è in continuo vasospasmo.
Mediante un’influenza diretta si ha invece la formazione della placca aterosclerotica e la proliferazione delle cellule muscolari lisce con conseguente danno endoteliale e ridotta elasticità del vaso. Questo perché l’omocisteina in eccesso forma il complesso omocisteina-tiolattone che reagendo con le LDL (lipoproteine a bassa densità) forma un complesso insolubile LDL-Tiolattone che viene fagocitato dai macrofagi che, incapaci di scinderlo, si trasformano in cellule schiumose costituendo il “core” dell’ateroma. L’omocisteina in eccesso può anche comportarsi da radicale libero dell’ossigeno provocando: disfunzione endoteliale e poi necrosi delle cellule endoteliali con loro distacco dalla parete vasale; proliferazione delle cellule muscolari lisce con successiva fibrosi e fibrocalcificazione della parte vasale, ossidazione dei lipidi di membrana con perdita della funzionalità di queste strutture; ossidazione delle LDL che diventano fortemente aterogene.
Azione sulle piastrine: l’omocisteina in eccesso aumenta l’adesività e l’aggregazione piastrinica.
Azione sui fattori della coagulazione: l’omocisteina in eccesso influenza i fattori che regolano la coagulazione del sangue.
È per questi motivi che da alcuni anni l’iperomocisteinemia, è considerata un importante fattore di rischio per lo sviluppo di alcune patologie molto gravi.
Omocisteina e malattie vascolari
Studi clinici ed epidemiologici hanno dimostrato una relazione tra elevati livelli plasmatici di omocisteina e malattie vascolari.
Patologie cardiovascolari: l’iperomocisteinemia è da molti ritenuta un fattore di rischio per l’aterosclerosi coronarica e l’infarto miocardico (Wald, 2006). Una popolazione di pazienti in cui il rischio cardiovascolare è elevato, e ulteriormente aggravato da elevati valori di Omocisteina è quella dei soggetti che sono stati sottoposti a trapianto cardiaco; sembra infatti che l’iperomocisteinemia che si sviluppa in seguito al trapianto possa favorire l’aterosclerosi del graft, una tra le principali limitazioni della sopravvivenza a lungo termine di questi pazienti (Ambrosi, 1994).
Patologie cerebrovascolari: l’iperomocisteinemia è responsabile di un danno a carico delle piccole arterie cerebrali. Uno studio recente (Martilelli, 2003) ha evidenziato che i pazienti con iperomocisteinemia presentano un rischio 4 volte superiore alla norma di andare incontro a episodi di trombosi dei seni venosi cerebrali.
Ictus cerebrale: numerosi studi hanno dimostrato una relazione significativa tra la concentrazione nel sangue di questo aminoacido ed eventi ischemici cerebrali (Wald, 2006). L’omocisteina, infatti, provoca l’ateromatosi cerebrale, responsabile poi degli eventi ischemici con meccanismi che non sono ben noti, sicuramente incrementando la produzione di radicali liberi, le lesioni della parete interna dei vasi e l’ispessimento della parete muscolare. In uno studio più recente (Lu Hao, 2013) un gruppo di ricercatori ha voluto indagare se elevati livelli di omocisteina e iperlipidemia nel sangue, in associazione, potessero avere un effetto sinergico e aumentare il rischio di ictus. Il risultato delle loro analisi retrospettive durate 5 anni (2007-2012), hanno confermato l’ipotesi: chi aveva elevati livelli di omocisteina e di lipidi (colesterolo e trigliceridi) nel sangue, a parità di altri fattori di rischio, aveva un quaranta per cento in più di probabilità di andare incontro a ictus rispetto al gruppo di controllo con valori normali. La compresenza di iperomocisteinemia e iperlipidemia ha dunque un effetto sinergico negativo.
Patologie vascolari periferiche quali le trombosi arteriose e venose in particolare la trombosi venosa profonda, una malattia che colpisce generalmente gli arti inferiori con il conseguente rischio che il coagulo migri fino ai polmoni causando l’embolia polmonare (Den Heijer, 1996), sono correlate anche all’iperomocisteinemia.
Malattia cerebrale dei piccoli vasi (CSVD): in uno studio recente (Kloppenborg, 2014) è stato dimostrato che l’omocisteina (che promuove la disfunzione endoteliale attraverso vari processi) svolge un ruolo nello sviluppo della malattia generalizzata dei piccoli vasi, coinvolgendo sia il cervello sia il rene. Gli stessi autori commentano che la funzione della molecola potrebbe essere regolata con un trattamento vitaminico e potrebbe pertanto costituire un potenziale target per la terapia. Inoltre La significativa associazione di un elevato livello di tHcy (omocisteina totale) con la progressione di CSVD sembra essere più forte in pazienti con una storia di malattia cerebrovascolare, indicando che questi pazienti sono più vulnerabili agli effetti dell’omocisteina e alla progressione della CSVD.
Aneurisma dell’aorta addominale (AAA): un recente studio (Takagi, 2014) di metanalisi ha dimostrato l’associazione tra i livelli di omocisteina e l’aneurisma dell’aorta addominale. Una serie di analisi ha dimostrato un significativo aumento dei livelli di omocisteina totale nel gruppo con AAA rispetto al gruppo di controllo e un altro gruppo di analisi ha dimostrato un aumento statisticamente significativo dell’incidenza in AAA per i soggetti con iperomocisteinemia.
Omocisteina e ipertensione
L’omocisteina elevata, fattore di rischio cardiovascolare può agire, come detto sopra, come fattore di rischio sia diretto (favorendo l’aterosclerosi) che indiretto cioè favorendo le complicanze dell’aterosclerosi, una delle quali è proprio l’ipertensione arteriosa.
Alcuni studi suggeriscono che l’omocisteina possa giocare un ruolo nello sviluppo dell’ipertensione, e come tale può fornire un potenziale meccanismo di collegamento con omocisteina e malattie vascolari. L’evidenza sperimentale ha dimostrato che elevati livelli di omocisteina hanno effetti negativi sul vasodilatatore NO, sulla proliferazione delle cellule muscolari lisce, alterano la funzione endoteliale, l’elasticità della parete vascolare e la funzione renale. Dato che fattori fisiologici quali la resistenza periferica, la rigidità arteriosa e la funzione renale sono fattori determinanti la pressione sanguigna, sarebbe ragionevole prevedere un’associazione tra omocisteina e pressione sanguigna.
L’iperomocisteinemia: prevenzione
L’iperomocisteinemia può dipendere da diversi fattori sia genetici che ambientali, oltre che da patologie renali e a particolari condizioni come la gravidanza, la menopausa, alcune terapie farmacologiche (contraccettivi orali, antiepilettici) ed infine da squilibri alimentari. Molti di questi fattori purtroppo non possono essere modificati.
Un discorso a parte merita invece lo stile di vita: tabagismo, abuso di sostanze alcoliche e caffeina, scarsa attività fisica e alimentazione povera di frutta e verdura sono considerati cause dell’iperomocisteinemia.
E’ stato dimostrato che l’assunzione di folati e vitamine B6 e B12 è in grado di contrastare l’accumulo di omocisteina, anche in presenza di altre cause, costituendo un valido sistema preventivo.
Luciano ALLEGRETTI, Direttore Scientifico Centro Iperbarico NIKE srl – Lecce
BIBLIOGRAFIA
Cattaneo M. Hyperhomocysteina, Atherosclerosis and Thrombosis. Thromb Haemost 1999; 81: 165-76.Cetin I., Berti C., Calabrese S. Role of micronutrientes in the periconceptional period. Human reproduction Update, vol.0, n.0 pp. 1-16, 2009.De Leo V, la Marca A, Morgante G, Musacchio MC, Luisi S, Petraglia F. Menopause, the cardiovascular risk factor homocysteine, and the effects of treatment. Department of Pediatrics, Obstetrics and Reproductive Medicine, Institute of Obstetrics and Gynecology, University of Siena, Siena 53100, Italy.Durga j. at al. Folic acid supplementation for 3 years significantly improved domains of cognitive function that tend to decline with age. Lancet 2007, Jan 20; 369 (9557); 166-7. Leopardi P, Marcon F., Caiola S., Siniscalchi E., Zijno A., Crebelli R. Il polìmorfismo della metilenetetraidrofolatoreduttasi 677C-T e l’interazione con acido folico e riboflavina. Workshop- Network Italiano Promozione Acido Folico-Prevenzione Primaria di Difetti Congeniti. Istituto Superiore di Sanità Roma, 5 ottobre 2007.Lonn E, Yusuf S, Arnold MJ et al. Heart Outcomes Prevention Evaluation (HOPE) 2 Investigators. Homocysteine lowering with folic acid and B vitamins in vascular disease. N Engl J Med. 2006;354(15):1567-77. Erratum in: N Engl J Med 2006;355(7):746.McCaddon A., Hudson P., Davies-G., Hunghes A., Williams J.H. Homocysteine and cognitive decline in healty elderly. Dementia and geriatric cognitive disorders, Sep-oct 2001, vol.12 n.5: 309-13.McLean RR, Jacques PF, Selhub J, et al. Homocysteine as a predictive factor for hip fracture in older persons. N Engl J Med. 2004;350(20):2042-9. Ripa R., Ripa S. Omocisteina: un fattore di rischio cardiovascolare trascurato. Progress Nutrition 2003 Vol. 5, n. 3, 248-261. Russo G.T., Cucinotta D. Iperomocisteinemia e rischio cardiovascolare nel diabete mellito. Ann Ist Super Sanità 2003;39(2):153-163.Van Meurs JB, Dhonukshe-Rutten RA, Pluijm SM et al. Homocysteine levels and the risk of osteoporotic fracture. N Engl J Med. 2004;350(20):2033-41.Verhoef P., Stampfer MJ, Buring JE, at al. Homocysteine metabolism and risk of myocardial infarction. Relation with vitamins B6, B12 and folate. Am, J. Epidemiol 1966; 143:845-59.Wald D., J. K. Morris, M. Law, N. J. Wald. Folic acid, homocysteine, and cardiovascular disease: judging causality in the face of inconclusive trial evidence. BMJ vol. 333 25 Nov. 2006.Satta E., Perna A.F., Lombardi C., Acanfora F., Violetti E., Romano M.M., Capasso R.; Pisano M., Paduano F., De Santo N.G. L’iperomocisteinemia nell’insufficienza renale cronica: aspetti clinici, nutrizionali e tossicità. Giornale Italiano di Nefrologia/Anno 23 n. 5, 2006/pp. 480-489.Finocchiaro P., Zoccali C.. Iperomocisteinemia e progressione dellenefropatie. Giornale Italiano di Nefrologia / Anno 22 n. 6, 2005/pp. 590-596.Chierigo P., Dedola S.,. Taccola M.C, Saugo M., Rossetto L., FranzolinN. Quadri clinici andrologici in pazienti con iperomocisteinemia. Journal of Andrological Sciences. Vol. 18, N.1, March 2011. pp 42-43.Bandello F., Varano M. Documento di Consenso: Gestione dei Pazienti con Diagnosi di Occlusione Venosa Retinica. IRCCS Fondazione G.B. Bietti per lo Studio e la Ricerca in Oftalmologia – Istituto Scientifico Universitario San Raffaele.Cretì A., Scenna G., De Notaris M., Brancaccio V., Giuliani C., De Rosa P. Manifestazioni oculari in pazienti con iperomocisteinemia . Fonte: neurologa Elena Guaschinio dell’IRCCS Mondino di Pavia. Pubblicazione 02/2010 su Cefalee Today. Seshadri S, Beiser A, Selhub J, Jacques PF, Rosenberg IH, D’Agostino RB, Wilson PW, Wolf PA. Plasma homocysteine as a risk factor for dementia and Alzheimer’s disease. N Engl J Med. 2002 Feb 14;346(7):476-83. Antonio Siniscalchi. Iperomocisteinemia nelle malattie neurologiche. RpM Programma periodico di Educazione Medica Continua Vol. 95, N. 7-8, Luglio-Agosto 2004. Dierkes J, Westphal S, Luley C. The effect of fibrates and other lipid-lowering drugs on plasma homocysteine levels. Expert Opin Drug Saf. 2004 Mar;3(2):101-11. Hadithi M., Mulder C., Stam F., Azizi .J, Crusius J., Peña A., Stehouwer C., Smulders Y. Effect of B vitamin supplementation on plasma homocysteine levels in celiac disease. World J Gastroenterol 2009 February 28; 15(8): 955-960.International Task Force for Prevention Of Coronary Heart Disease: Coronary heart disease and stroke: Risk factors and global risk. Homocysteine, heart disease and stroke http://www.chd-taskforce.de/pdf/sk_homocysteine.pdf. Ding R., Lin s, Chen D. The association of Cystathionine βSynthase (CBS) T833C polymorphism and the risk of stroke: A meta-analysis. Journal of the Neurological Sciences 312 (2012) 26–30.Rogers JD, Sanchez-Saffon A, Frol AB, Diaz-Arrastia R. Elevated plasma homocysteine levels in patients treated with L-dopa. Arch Neurol 2003. 60:59–64.Siniscalchi A., Gallelli L., Mercuri N. B., Ibbadu G., and De Sarro G. Role of lifestyle factors on plasma homocysteine levels in Parkison’s disease patients treated with levodopa. Nutritional Neuroscience (2006), 9:1, 11 – 16.Sudchada P, Saokaew S, Sridetch S, Incampa S, Jaiyen S, Khaithong W. Effect of folic acid supplementation on plasma total homocysteine levels and glycemic control in patients with type 2 diabetes: A systematic review and meta-analysis. Diabetes Res Clin Pract. 2012 Oct;98(1):151-8. doi: 10.1016/j.diabres.2012.05.027. Epub 2012 Jun 22.Satta E., Perna A.F., Lombardi C., Acanfora F., Violetti E., Romano M.M., Capasso R., Pisano M., Paduano F., De Santo N.G.L’iperomocisteinemia nell’insufficienza renale cronica: aspetti clinici, nutrizionali e tossicità. Giornale Italiano di Nefrologia / Anno 23 n. 5, 2006 / pp. 480-489. Chierigo P., Dedola S., Taccola M.C., Saugo M., Rossetto L., Franzolin N. Quadri clinici andrologici in pazienti con iperomocisteinemia. Journal of Andrological Sciences Vol. 18 No. March 2011. Cretì A., Scenna G., De Notaris M., Brancaccio V., Giuliani C., De Rosa P. Manifestazioni oculari in pazienti con iperomocisteinemia. www.farmigea.itVento Claudio. Corso di Neuroanatomia: comorbidità malattia cerebrovascolare/emicrania: correlati anatomici. Università Degli Studi Di Roma “La Sapienza” anno 2003-2004.Capaccio P, Ottaviani F, Cuccarini V, Ambrosetti U, Fagnani E, Bottero A, Cenzuales S, Cesana BM, Pignataro L. Le mutazioni del gene della metilentetraidrofolato-reduttasi (MTHFR) quali fattori di rischio per la sordità improvvisa. iAm J Otolaryngol. 2005 Nov-Dec;26(6):383-7.Vestita M., Cassano N., Vena G.A. Associazione tra psoriasi e rischio cardiovascolare: cosa c’è di nuovo? 2010 – http://www.tuttosanita.it/ArchivioDocumenti. Limonta M. Rischio cardiovascolare nelle malattie reumatiche autoimmuni. http://www.cardiometabolica.org. Di Lascio G., Di Lascio S. Depressione come malattia sistemica I° – Folati omocisteina e depressione. Notiziario Gennaio 2012 N°1 http://www.associazioneamec.com/notiziario-amec/anno-2012/272-notiziario-gennaio-2012-nd1-depressione-come-malattia-sistemica.html?start=13. Patrick Holford. Manuale di nutrizione familiare ed. tecniche Nuove 2008. Cap. 16. Ambrosi P, Barlatier A, Habib G, Gargon D. Hyperhomocysteinemia in heart transplanted recipients. Eur Heart J 1994; 15: 1191-1196. Den Heijer M., Koster T. Blom H.J., Bos G. M.J., Briët E., Reitsma P.H., Vandenbroucke J. P. and Rosendaal F.R.. Hyperhomocysteinemia as a Risk Factor for Deep-Vein Thrombosis N Engl J Med 1996; 334:759-762March 21, 1996DOI: 10.1056/NEJM199603213341203. C. P. Wilson, H. McNulty, J. M. Scott, J. J. Strain and M. Ward. The MTHFR C677T polymorphism, B-vitamins and blood pressure. Proceedings of the Nutrition Society (2010), 69, 156–165. Zamzam Paknahad,1,2 Ahmad Chitsaz,3 Akbar Hasan Zadeh,1,2 and Elham Sheklabadi. Effects of Common Anti-epileptic Drugs on the Serum Levels of Homocysteine and Folic Acid Int J Prev Med. 2012 March; 3(Suppl1): S186–S190.
Leave a reply →

